Шкала пш среды. Что такое кислотность и методы ее определения
Определение кислотности
При контроле производства пищевых концентратов кислотность является одним из основных показателей, характеризующих доброкачественность сырья и готовой продукции. Кислотность относится также к основным факторам, по которым судят о направлении биохимических и физико-химических процессов пищеконцентратного и овощесушильного производства.
В практике контроля определяют кислотность общую, или титруемую, и активную, т.е. концентрацию водородных ионов – pH (пш).
Определение общей кислотности
Под общей кислотностью подразумевается содержание в продукте всех кислот и веществ, реагирующих со щелочью. Общая кислотность выражается в следующих величинах:
в процентах по массе (весовых) какой-либо кислоты, преобладающей в данном продукте (молочной, лимонной, яблочной и др.);
в «градусах», т.е. в миллилитрах 1 н. щелочи, пошедшей на нейтрализацию кислых соединений в 100 г продукта.
Для выражения кислотности в весовых процентах определенной кислоты количество миллилитров 0,1 н. щелочи, затраченной на нейтрализацию кислых соединений в 100 г продукта, умножают на миллиэквивалент соответствующей кислоты. Общая кислотность может быть определена титрованием раствором щелочи водных растворов продукта в присутствии индикатора до изменения его окраски или потенциометрически методом электрометрического титрования.
Определение кислотности титрованием
Кислотность продукта этим методом определяют в водных вытяжках исследуемых продуктов либо по «болтушке».
В водных вытяжках кислотность определяют следующим образом. В зависимости от характера исследуемого продукта и предполагаемой кислотности берут навеску измельченного продукта в количестве примерно 10 г (точность взвешивания до 0,01 г). Навеску переносят в колбу емкостью 250 мл, заливают 200 мл дистиллированной воды и настаивают в течение 30 мин при частом взбалтывании. Содержимое колбы доводят дистиллированной водой до метки, хорошо перемешивают и фильтруют через бумажный фильтр в сухую колбу. Отмеривают пипеткой 20-25 мл фильтрата, переносят в коническую колбу и титруют 0,1 н. раствором щелочи в присутствии 3-5 капель фенолфталеина до розового окрашивания. Если вытяжки окрашены, то их разбавляют в 2-3 раза дисциллированной водой.
Кислотность рассчитывают по формуле
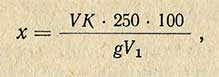
где V – количество точно 0,1 н. щелочи, пошедшей на титрование, мл; К – коэффициент пересчета на соответствующую кислоту. Для молочной кислоты К – 0,0090, лимонной – 0,0064, яблочной – 0,0067, винной 0,0075, уксусной – 0,0060; g – навеска исследуемого продукта, г; V1 – количество фильтрата, взятого для титрования, мл.
При определении кислотности по «болтушке» навеску измельченного продукта 5 г, взятую с точностью до 0,01 г, переносят в коническую колбу емкостью 150-250 мл, в которую предварительно наливают 30-40 мл дистиллированной воды. Содержимое колбы взбалтывают в течение 2-3 мин до полного исчезновения комочков продукта. Прилипшие к стенкам колбы мелкие частицы смывают дистиллированной водой, в болтушку добавляют пять капель 1%-ного раствора фенолфталеина и титруют 0,1 н. раствором щелочи. Титрование ведут медленно (особенно в конце реакции), при постоянном тщательном взбалтывании содержимого колбочки, до появления ярко-розового окрашивания, не исчезающего в течение 1 мин.
Кислотность, выражаемую в градусах на 100 г изделий (х), вычисляют по формуле
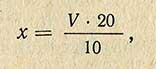
где V – количество 0,1 н. раствора щелочи, пошедшей на титрование, мл; 20 – коэффициент пересчета на 100 г изделий; 10 – коэффициент пересчета на 1 н. раствор щелочи.
Расхождение между результатами параллельных определений не должно превышать 0,5°. Метод электрометрического титрования применяют при определении кислотности интенсивно окрашенных или мутных растворов.
Определение кислотности электрометрическим титрованием
Он основан на определении электропроводности исследуемого раствора при титровании его раствором щелочи. В цепи гальванического элемента, состоящего из двух хингидронных электродов, возникает разность потенциалов, когда один из электродов погружен в стандартный раствор с нейтральной реакцией, а другой в исследуемый раствор. При титровании испытуемого раствора раствором щелочи разность потенциалов снижается. По достижении нейтральной точки разность потенциалов равна нулю, ток в цепи исчезает, потенциал индикаторного электрода оказывается равным потенциалу электрода сравнения. Отсутствие тока устанавливают по гальванометру гальванического элемента, включенного в цепь.
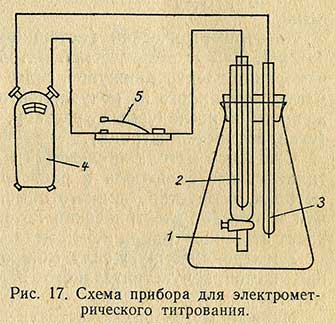
Для электрометрического титрования применяют специальную установку или приборы для измерения pH (пш): ИМ-2М, ЛП-58 (рис. 16, а), ЛПУ-01 (рис. 16, б) и др. Схема специальной установки изображена на рис. 17. Этот прибор состоит из конической колбы емкостью 250-300 мл, в которую вставлена пробка с тремя отверстиями. В одно отверстие вставлена стеклянная трубка с краном 1 (диаметр трубки 0,8-1 см, длина 15-20 см).
В трубку наливают 5-8 мл насыщенного раствора хлористого калия, нейтрализованного 0,01 н. раствором щелочи в присутствии фенолфталеина до слабо-розовой окраски. Конец трубки ниже крана также должен быть заполнен раствором KCl, чтобы в трубке не было пузырьков воздуха. В трубку 1 вставляют при помощи резинового кольца платиновый электрод 2. Во второе отверстие колбы вводят платиновый электрод 3; в третье отверстие – конец бюретки, которую наполняют раствором щелочи. Один электрод при помощи звонковой проволоки присоединяют непосредственно к одному из контактов гальваномера 4, другой электрод присоединяют к телеграфному ключу 5, а затем от него к другому контакту гальванометра.
При определении в коническую колбу переносят 25-50 мл исследуемой жидкости, в случае необходимости доводят объем жидкости в колбе до 50-60 мл свежепрокипяченной дистиллированной водой. В колбу с жидкостью вносят на кончике ножа (10-20 мг) хингидрон и содержимое осторожно перемешивают. Немного хингидрона вносят также в трубку с раствором хлористого калия и перемешивают погруженным в него платиновым электродом. Колбу закрывают пробкой, при этом концы электродов должны быть погружены в жидкость. Затем в третье отверстие вставляют насадку бюретки с раствором 0,1 н. щелочи. Нажимая на ключ 5, проверяют действие прибора по наличию тока в цепи и отклонению стрелки гальванометра.

После этого жидкость в колбе титруют 0,1 н. раствором щелочи, приливая небольшие количества раствора щелочи и каждый раз взбалтывая содержимое колбы. Затем короткими и быстрыми движениями нажимают ключ и отмечают движение стрелки гальванометра. К концу титрования добавляют раствор щелочи по одной капле. Титрование считается законченным, если после прибавления последней капли щелочи в цепи не обнаруживается тока. По количеству миллилитров 0,1 н. раствора щелочи, пошедшей на титрование, рассчитывают кислотность по общепринятой формуле.
После проведения определения колбу, электроды и трубку тщательно смывают дистиллированной водой. В период, когда не проводят определения кислотности, электроды должны быть погружены в дистиллированную воду.
Определение активной кислотности (pH)
Активная кислотность раствора выражается концентрацией активных водородных ионов (pH). Кислоты, щелочи и соли в водных растворах диссоциируют на ионы водорода Н и гидроксила ОН’, поэтому кислотность или щелочность среды обусловлена наличием в ней ионов водорода или гидроксила.
В единице объема нейтрального раствора содержится равное число ионов водорода и гидроксила. Концентрация водородных ионов чистой воды выражается в виде десятичного логарифма, взятого с отрицательным знаком, и обозначается символом pH (рн). Химически чистая вода обладает нейтральной реакцией и ее pH – lg10-7 = 7.
В кислой среде число ионов водорода больше числа ионов гидроксила и величина pH (рн) будет меньше 7. В щелочной среде ионы гидроксила преобладают над ионами водорода, величина pH при этом будет больше 7.
Активную кислотность определяют в основном электрометрическим методом при помощи специальных приборов – потенциометров. При ориентировочном определении pH можно пользоваться специальными индикаторными бумажками, снабженными шкалой сравнения. Для этого на индикаторную бумажку наносят испытуемый раствор и по образовавшейся окраске определяют величину pH, сравнивая полученную окраску со шкалой сравнения.
Электрометрический (потенциометрический) метод определения pH. Электрометрический метод определения pH основан на измерении электродвижущей силы (э.д.с.) гальванического элемента, собранного из полуэлемента основного электрода, погруженного в исследуемый раствор, и полуэлемента сравнения (стандартного электрода). Сущность потенциометрического метода заключется в том, что при погружении металлического электрода в раствор, содержащий ионы того же металла, вследствие ионного обмена электрод заряжается и на нем возникает электрический потенциал, величина которого зависит от концентрации ионов металла в растворе.
Электродвижущую силу можно измерять двумя методами: при помощи чувствительного вольтметра и компенсационным методом. Первый метод заключается в соединении обоих электродов через вольтметр, показывающий величину э.д.с. элемента. Этот метод менее точен, так как во время измерения непрерывно расходуется ток и при весьма низких значениях силы тока в концентрационном элементе возникает погрешность в результатах измерения э.д.с. Компенсационный метод измерения э.д.с. наиболее точен потому, что э.д.с. исследуемого элемента, вызывающей ток в цепи, противопоставляют другую известную по величине э.д.с., которая также вызывает ток в той же цепи, но в обратном направлении.
В практике контроля для определения pH (рн) пользуются специальными приборами – потенциометрами, основой электрической схемы которых служит компенсационный метод измерения э.д.с. В этих приборах цена деления реохорда откалибрована в милливольтах или в единицах pH. Милливольты э.д.с. переводят в значения pH по специальным таблицам.
Наиболее широкое распространение получили следующие потенциометры: П-4, ЛП-5, ППТВ-1, ЛП-58 и ЛПУ-01. Методика определения pH и схемы устройств потенциометров обычно описаны в инструкциях, прилагаемых к приборам.
При определении pH в растворах, не содержащих сильных окислителей и восстановителей, можно применять прибор более простой конструкции – иономер ИМ-2М (рис. 18). Действие иономера основано на измерении милливольтметром э.д.с. гальванического элемента при погружении его электродов в исследуемый раствор.
Рабочим электродом в гальваническом элементе представлен сурьмяный электрод 1, который изготовлен в виде чаши, отлитой из металлической сурьмы. Электродом сравнения является насыщенный хлорсеребряный полуэлемент 2. Шкала измерительного магнитоэлектрического прибора 3 градуирована в милливольтах от 0 до 600 и в единицах pH от 0 до 12.
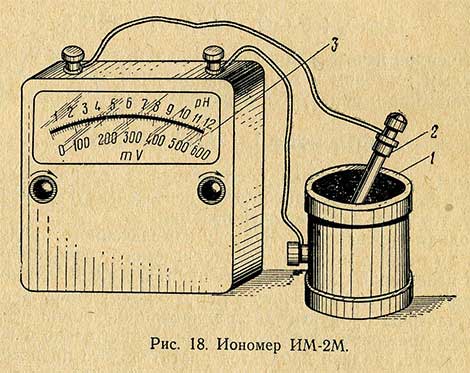
Точность иономера невелика и находится в пределах ±0,3pH. Однако применение его позволяет просто и быстро определить pH в широком диапазоне (от 1 до 12), причем в интервале температур от 10 до 35° С. Кроме того, для иономера не требуется источников электрического питания.
Водородный показатель кислотности (рН)
Водородный показатель, pH (лат. pondus Hydrogenii — «вес водорода», произносится «пэ аш») — мера активности (в сильно разбавленных растворах эквивалентна концентрации) ионов водорода в растворе, которая количественно выражает его кислотность. Равен по модулю и противоположен по знаку десятичному логарифму активности водородных ионов, которая выражена в молях на один литр:
 .
.
История водородного показателя pH .
Понятие водородного показателя введено датским химиком Сёренсеном в 1909 году. Показатель называется pH (по первым буквам латинских слов potentia hydrogeni — сила водорода, либо pondus hydrogeni — вес водорода). В химии сочетанием pX обычно обозначают величину, которая равна lg X, а буквой H в этом случае обозначают концентрацию ионов водорода (H + ), либо, вернее, термодинамическую активность гидроксоний-ионов.
Уравнения, связывающие pH и pOH .
Вывод значения pH .
В чистой воде при 25 °C концентрации ионов водорода ([H + ]) и гидроксид-ионов ([OH − ]) оказываются одинаковыми и равняются 10 −7 моль/л, это четко следует из определения ионного произведения воды, равное [H + ] · [OH − ] и равно 10 −14 моль²/л² (при 25 °C).
Если концентрации двух видов ионов в растворе окажутся одинаковыми, в таком случае говорится, что у раствора нейтральная реакция. При добавлении кислоты к воде, концентрация ионов водорода возрастает, а концентрация гидроксид-ионов понижается, при добавлении основания — напротив, увеличивается содержание гидроксид-ионов, а концентрация ионов водорода уменьшается. Когда [H + ] > [OH − ] говорится, что раствор оказывается кислым, а при [OH − ] > [H + ] — щелочным.
Чтоб было удобнее представлять, для избавления от отрицательного показателя степени, вместо концентраций ионов водорода используют их десятичный логарифм, который берется с противоположным знаком, являющийся водородным показателем — pH.
 .
.
Показатель основности раствора pOH .
Немного меньшую популяризацию имеет обратная pH величина — показатель основности раствора, pOH, которая равняется десятичному логарифму (отрицательному) концентрации в растворе ионов OH − :
как во всяком водном растворе при 25 °C  , значит, при этой температуре:
, значит, при этой температуре:
 .
.
Значения pH в растворах различной кислотности.
- Вразрез с распространённым мнением, pH может изменяться кроме интервала 0 – 14, также может и выходить за эти пределы. Например, при концентрации ионов водорода [H + ] = 10 −15 моль/л, pH = 15, при концентрации ионов гидроксида 10 моль /л pOH= −1.
Т.к. при 25 °C (стандартных условиях) [H + ] [OH − ] = 10 −14 , то ясно, что при такой температуре pH + pOH = 14.
Т.к. в кислых растворах [H + ] > 10 −7 , значит, у кислых растворов pH 7, pH нейтральных растворов равняется 7. При более высоких температурах константа электролитической диссоциации воды увеличивается, значит, увеличивается ионное произведение воды, тогда нейтральной будет pH = 7 (что соответствует одновременно возросшим концентрациям как H + , так и OH − ); с понижением температуры, наоборот, нейтральная pH увеличивается.
Методы определения значения pH .
Существует несколько методов определения значения pH растворов. Водородный показатель приблизительно оценивают при помощи индикаторов, точно измерять при помощи pH-метра либо определять аналитическим путём, проводя кислотно-основное титрование.
- Для грубой оценки концентрации водородных ионов часто используют кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. Самые популярные индикаторы: лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и др. Индикаторы могут быть в 2х по-разному окрашенных формах — или в кислотной, или в основной. Изменение цвета всех индикаторов происходит в своём интервале кислотности, зачастую составляющем 1–2 единицы.
- Для увеличения рабочего интервала измерения pH применяют универсальный индикатор, который является смесью из нескольких индикаторов. Универсальный индикатор последовательно изменяет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным способом затруднено для мутных либо окрашенных растворов.
- Применение специального прибора — pH-метра — дает возможность измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем при помощи индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, которая включает стеклянный электрод, потенциал которого зависим от концентрации ионов H + в окружающем растворе. Способ обладает высокой точностью и удобством, особенно после калибровки индикаторного электрода в избранном диапазоне рН, что дает измерять pH непрозрачных и цветных растворов и поэтому часто применяется.
- Аналитический объёмный метод — кислотно-основное титрование — тоже даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) каплями добавляют к раствору, который исследуется. При их смешивании происходит химическая реакция. Точка эквивалентности — момент, когда титранта точно хватает, для полного завершения реакции, — фиксируется при помощи индикатора. После этого, если известна концентрация и объём добавленного раствора титранта, определяется кислотность раствора.
- Влияние температуры на значения pH:
0,001 моль/Л HCl при 20 °C имеет pH=3, при 30 °C pH=3,
0,001 моль/Л NaOH при 20 °C имеет pH=11,73, при 30 °C pH=10,83,
Влияние температуры на значения pH объясняют разчной диссоциацией ионов водорода (H + ) и не есть ошибкой эксперимента. Температурный эффект нельзя компенсировать за счет электроники pH-метра.
Роль pH в химии и биологии.
Кислотность среды имеет важное значение для большинства химических процессов, и возможность протекания либо результат той или иной реакции зачастую зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований либо на производстве применяют буферные растворы, позволяющие сохранять почти постоянное значение pH при разбавлении либо при добавлении в раствор маленьких количеств кислоты либо щёлочи.
Водородный показатель pH часто применяют для характеристики кислотно-основных свойств разных биологических сред.
Для биохимических реакций сильное значение имеет кислотность реакционной среды, протекающих в живых системах. Концентрация в растворе ионов водорода зачастую оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается под действием буферных систем организма.
В человеческом организме в разных органах водородный показатель оказывается разным.
Некоторые значения pH.
Что такое кислотность и методы ее определения
Кислотность водного раствора обусловлена наличие в нем положительных водородных ионов Н+ и оценивается концентрацией в 1 литре раствора C(H+) (моль/л или г/л). В абсолютно чистой воде концентрации ионов Н+ и ОН– равны и раствор нейтрален. В кислых растворах преобладают ионы Н+, в щелочных – ионы ОН–, однако их произведение в любых условиях постоянно. Следовательно, увеличение концентрации одного типа ионов приводит к уменьшению концентрации другого типа в том же количестве. На практике степень кислотности (или щелочности) раствора выражается водородным показателем рН (от латинского «пундус гидрогениум» — вес водорода), представляющим собой отрицательный десятичный логарифм молярной концентрации водородных ионов рН = –lgC(H+). Эта величина может изменяться в небольших пределах – всего от –1 до 15 (а чаще – от 0 до 14). При этом изменению концентрации ионов Н+ в 10 раз соответствует изменение рН на одну единицу. Таким образом, концентрация водородных ионов в среде с рН = 5 в 10, 100 и 1000 раз выше, чем в среде с рН = 6, 7 и 8 соответственно.
Кислыми называют растворы, в которых рН 7, и, чем ближе это значение к 14, тем раствор считается более щелочным. Установленная шкала кислотности идет от рН = 0 (крайне высокая кислотность) до рН = 14 (крайне высокая щелочность). Нейтральная среда имеет показатель ph, равный 7 (при комнатной температуре).
Показатель рН непосредственно влияет на нормальное протекание всех биохимических процессов у живых организмов. Очень важно, чтобы все процессы проходили при строго заданной кислотности. В частности, это необходимо для нормального функционирования биологических катализаторов – ферментов (при выходе за эти пределы их активность может резко снижаться). В клетках организма рН имеет значение около 7, во внеклеточной жидкости – 7,4. Наиболее чувствительны к изменению ph нервные окончания, которые находятся вне клеток. Кроме того, организм использует данное изменение ph в сигнальных целях: при механических или термических повреждениях тканей стенки клеток разрушаются и их содержимое попадает на нервные окончания. Было доказано, что боль вызывают именно катионы водорода, причем с уменьшением рН раствора боль усиливается, – и это лишь частный пример роли ph для живых организмов. Для примера, чистая природная, в частности дождевая, вода в отсутствие загрязнителей тем не менее имеет слабокислую реакцию (рН = 5,6), поскольку в ней легко растворяется углекислый газ с образованием слабой угольной кислоты.
Для определения степени кислотности используют специальные приборы – рН-метры, которые бывают весьма недешевы. Такие приборы измеряют электрический потенциал специального электрода (ЭДС), погруженного в раствор, и этот потенциал зависит от концентрации ионов водорода в растворе, и весьма вероятно измерить его с высокой точностью.
Простым способом определения характера среды является применение индикаторов – химических веществ, окраска которых изменяется в зависимости от рН среды. Наиболее распространенные индикаторы – фенолфталеин, метилоранж, лакмус. Метиловый оранжевый при рН 4,4 – желтый; лакмус при рН 8 – синий и т.д. В домашних условия без наличия этих индикаторов для определения кислотности среды вполне пригодны естественные красители из красной капусты и черной смородины.
Приборы для измерения водородного показателя (рН метры):
Источники:
https://www.spec-kniga.ru/tehnohimicheski-kontrol/tekhnohimicheskij-kontrol-ovoshchesushilnogo-i-pishchekoncentratnogo-proizvodstva/himicheskie-metody-analiza-opredelenie-kislotnosti.html
https://www.calc.ru/214.html
https://www.ecounit.ru/artikle_65.html



